Der Mensch verliert jede Stunde Zehntausende von Hautzellen und hinterlässt überall Spuren seiner Anwesenheit. In jeder dieser Zellen ist der gesamte DNA-Satz eines Individuums oder sogar mehrere Kopien davon enthalten. Fische und andere Organismen sind nicht anders, und Wissenschaftler haben begonnen, Wege zu erforschen, um die Umwelt zu beproben, um diese oft schwer fassbaren Hinweise auf die Anwesenheit einer Art in Form von „eDNA“ fest zu stellen. Es gibt zahlreiche Wege für Zellen und genetisches Material, um als eDNA in die Umwelt zu gelangen, einschließlich natürlicher Hautablösung, Darmschleimhaut, die mit Fäkalien ausgeschieden wird, Gewebe, das durch Verletzungen vom Körper abgetrennt wurde oder Zellen, die während der Fortpflanzung ins Wasser freigesetzt werden. Gerade bei Letzteren wird in der Diskussion mit Dr. Josef Wanzenböck vom Limnologischen Institut der UNI-Innsbruck eine Möglichkeit gesehen, unser formuliertes das Ziel, eine Übersicht über die „Äschen Bestände der Oberen Traun“ zu bekommen, anzusetzen.

Methoden
Es geht uns im „SÄEEP“ – Salzkammergut Äschen Erhaltung- und Entwicklungs-Projekt darum, eine Qualitätskontrolle zu bekommen, um verschiedene Maßnahmen und deren Erfolg zu messen.
Fische sind durch ihre Lebensdauer, ihren Lebenszyklus und aufgrund ihrer differenten Habitat Ansprüche ein guter Anzeiger für den ökologischen Zustand eines Gewässers. Darüber hinaus reagieren Fischpopulationen nicht nur auf anthropogene Einflüsse: natürliche Extremereignisse wie Baustellen mit Wassertrübungen, Hochwässer, Niederwasser und populationsinterne Faktoren können ebenfalls an der Ausprägung der Abundanz und der Altersstruktur beeinflussen. Auch wollen wir unsere Bemühungen im Bereich der Revitalisierungen, Laichplatz Verbesserungsmaßnahmen etc. bewerten und überprüfen und mit einer Qualitäts- Betrachtung über mehrerer Jahre gegenüberstellen. Dazu gibt es verschiedene Methoden.
Visuelle Bestandserhebungen
Im Vergleich zum Zählen erwachsener (adulter) Fische, die zum Laichen in unseren Flüsse umherziehen und sich zur Paarung sammeln, ist das Zählen ihrer Nachkommen viel schwieriger, als Sie vielleicht erwarten. Nicht nur ein paar erwachsene Salmoniden können Tausende von Nachkommen produzieren, die Werkzeuge, die wir zum Zählen von Fisch-Babys verwenden, bringen auch ihre eigenen Herausforderungen mit sich. Das wesentliche Rätsel ist, dass wir im Gegensatz zu erwachsenen Salmoniden nicht jedes Fisch-Baby in einem Fluss fangen und zählen können. Stattdessen müssen wir Schätzungen nach einem „Näherungsverfahren“ darüber anstellen, wie viele Fisch-Babys jedes Jahr geboren werden und überleben, basierend auf Stichproben von einem Teil ihrer Population. Aber wenn wir nie die wahre Anzahl von Individuen kennen können, woher wissen wir dann, ob unsere Schätzungen korrekt sind oder nicht, oder sind sogar nahe am wahren Wert? Daher beschäftigen wir uns im FROSKG mit dieser Herausforderung, die ein langfristige Überwachungsprogramm für juvenile Salmoniden darstellt und uns mit Schwerpunkt auf die „Obere Traun“ bezogen, auch Möglichkeiten zur Verbesserung der jährlichen Migrationsschätzungen geben soll. Dh. Learning by doing und laufende Verbesserungen in den Methoden entwickeln.
Elektrobefischung(en)
Die Möglichkeit per Elektrobefischung den Bestand zu ermitteln ist eine bekannte, verwendete und Eingeführte Methode. Diese haben wir in zeitlichen Abständen bereits in Verwendung und im Einsatz. Der Nachteil ist, dass bei einer Elektrobefischung der Jungfischbestand (Brütlinge) nicht oder kaum erfasst werden.

Einsatz von Sonar
Alternativ hatte ich die Idee, zur Laichzeit der Äschen per SONAR Aufnahmen den Laich Zug festzuhalten. Da dieser jedoch kein tatsächlicher Laich Zug ist, sondern ein Auf- und Ab, kommen wir mit dieser Methode auf keine erwünschtes Ergebnisse, da die Äschen nicht wie Reinanken, Perlfische, Lachse, Nasen oder andere Wanderfischarten flussaufschwimmen, sondern in ihren Laichgebieten verbleiben und damit zigfach, sich in einem SONAR Feld bewegen und dadurch keine Bestanderhebung möglich ist oder nur sehr aufwendig, mit Markierung der Fische.
Point abundance sampling
Da der Laicherfolg und die Eigenreproduktion im Gewässersystem der Oberen Traun ein Hauptmesskriterium darstellt, würde es noch mit „Point abundance sampling“ eine Methode geben um den Nachwuchs zu messen. Hier gibt es jedoch, wie z.B. beim Obst, gute und schlechte Jahre und damit ist eine Verbesserung- oder Verschlechterung Anhand von Brütling Zahlen auch nur ein sehr vage Kennzahl.
Daher kamen wir in einen Brainstorming zu der Erkenntnis, dass nicht die Kombination verschiedener Methoden, wie z.B. SONAR und „Point abundance sampling“ zu den gewünschten Kennzahlen führt, sondern, dass per eDNA im Flussnetzwerk der Oberen Traun der Weg zur gewünschten Bewertung, sprich Inventur der Äschen Bestände ein Weg ist, denn man gehen sollte um eDNA Kennzahlen zu erhalten, die für künftige eDNA Beprobungen in Relation gestellt werden können und sich dadurch Messgrößen ergeben.
SÄEEP eDNA Projekt
Im Zuge unseres SÄEEP – Salzkammergut Äschen Erhaltungs- und Entwicklungs-Projeketes sind wir auf der Suche nach neuen Methoden zur Qualitätskontrolle. Es geht darum den Erfolg von Maßnahmen bzw. potentielle Verschlechterungen zu messen und zu erkennen.

eDNA und Entwicklung von Kennzahlen
Im Einsatz von eDNA, geht es zumeist um eine Bewertung der Artenverteilung in einen Gewässersystem. Uns interessiert jedoch eine Kennzahl und zwar ein „Intensitätswert“ von Äschen DNA, der über den gesamten Äschen Bestand und die Ausbreitungswege im Gewässersystem der Oberen Traun zu bekommen. Wenn dies erreicht wird, hätten wir einen elegante Prozess des Sammelns und des Nachweises und damit einen wertvollen Parameter für künftige Vergleiche.
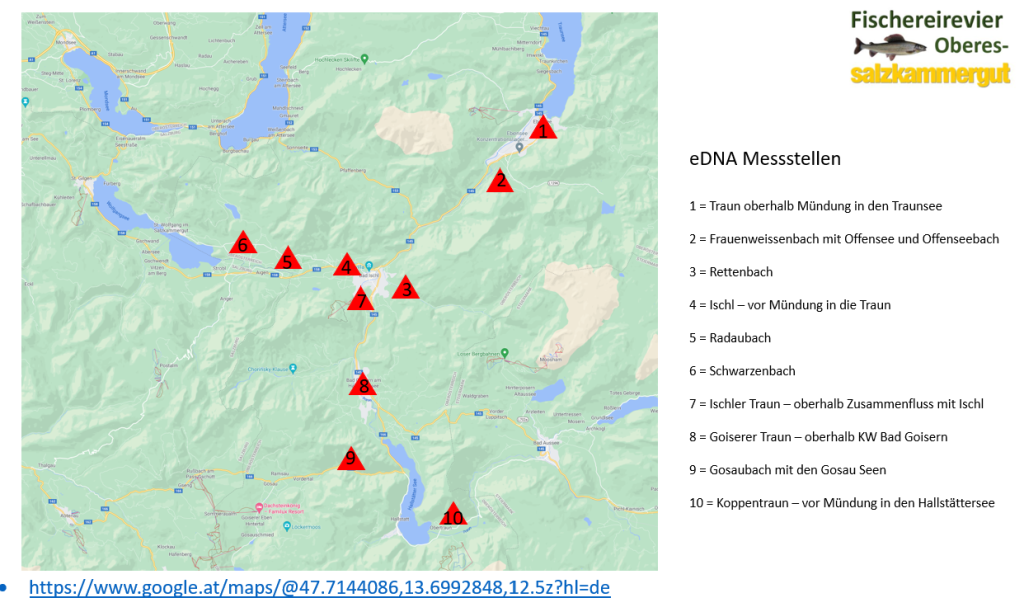
eDNA Messstellen
Folgende 10 definierten Hotspots, mit jeweils 3 Stichprobenziehung wurden definiert um die Identifizierung von Biodiversitäts-Hotspots und damit regional unterschiedliche Erhaltungsbemühungen aufzuzeigen.
Voraussichtliche Vorteile der eDNA Beprobung
Die eDNA-Methode zur Biodiversitätsüberwachung in Flüssen sollte mehrere Vorteile bringen, da sie für die meisten klassisch beprobten taxonomischen Gruppen nicht tödlich ist, die Störung des Lebensraums minimiert und die Diversität bewerten kann. Daher wird die Demonstration der Leistungsfähigkeit dieses Instruments zur Überwachung der Biodiversität wichtiger Indikatorgruppen in Flüssen ein schnelles, nicht tödliches und kostengünstiges Alternativinstrument im Vergleich zu klassischen, oben beschriebenen Methoden darstellen.
Die rasanten Fortschritte in der eDNA-Forschung in den letzten Jahren haben eine Reihe neuer Anwendungen hervorgebracht, um Fragen zu untersuchen, die zuvor unbeantwortbar waren. In unserer Situation geht es um die Feststellung, des Vorhandensein, die Verbreitung und die „Intensität“ von Äschen Beständen im Gewässersystem der Oberen Traun.

Erfolgskontrolle von Maßnahmen
Die Hauptaufgabe sehen wir in der Erfolgskontrolle von Besatzmaßnahmen und anderen Verbesserungsmaßnahmen im Gewässer. Angeblich kann man anhand der eDNA-Signalstärke auf Populationsdichten und Dominanzverhältnisse im Längsverlauf von Fließgewässern rückgeschlossen werden kann. Mittels umfassender Beobachtungen von Bestandsentwicklungen übers Jahr sollten so zukünftig die saisonale Entwicklung des Fischbestands überwacht und wertvolle Informationen darüber erlangt werden. Dies ermöglicht, das Renaturierungs-Potential von Rückbaumaßnahmen bzw. deren Erfolg zu beurteilen.
Nebenschauplätze
DNA-Extraktion zum Nachweis von PKD
RBF-Bestandserhebung
Weitere Informationen und Quellen
eDNA-based fish monitoring in Alpine rivers
Umwelt-DNA (eDNA) zur Bewertung des fischökologischen Zustands nach EU WRRL in Österreich
Mit eDNA den Fischen auf der Spur
„Wenn ich drei Zauberwünsche frei hätte,
so würde ich mir als dritten wünschen, in jedem Gewässer alle Fische sehen zu können.“
Zitat von: Dr. Günter Jens

